在细胞环境中,蛋白质周围水分子的取向取决于多种因素,如:蛋白质的表面结构、水分子与蛋白质之间的距离等。水分子的取向对于蛋白质的稳定性至关重要,并且有助于实现蛋白质的功能。当前,很多研究都集中在蛋白质周围水分子的平均取向。但是,蛋白质周围水分子的局部取向的相关研究较少,其影响机制需待深入。
美国西北大学的Baofu Qiao等人采用分子动力学(MD)模拟方法研究了PET降解酶、细胞色素C和有机磷水解酶的局部表面域与水分子取向的关系。结果表明:水分子的局部取向强烈依赖于蛋白质极性和非极性域特征,其第一水壳层中水分子的取向仅取决于与之形成H键的蛋白质表面基团的极性。对于远离蛋白质表面的水分子取向研究结果表明,处于该区域的水分子取向在很大程度上取决于蛋白质分子的净电荷,即当蛋白质带负电荷时,水分子朝内;当蛋白质带正电荷时,水分子则朝外。
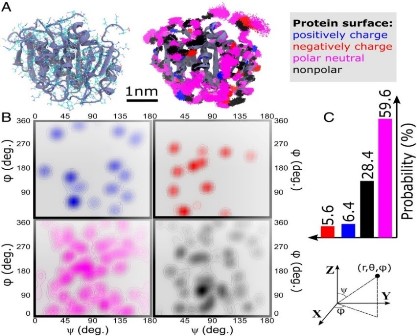
图1. 蛋白质表面的极性和非极性域
(图片来源:Proc. Natl. Acad. Sci., 2019, 116 (39) : 19274-19281)
通过上述研究,可以获得蛋白质表面的极性和非极性域如何影响水分子的局部取向的微观机制,加深人们对于蛋白质与水分子之间相互作用的分子层次认识,为进一步研究蛋白质与水分子之间的相互作用及重现蛋白质的功能提供理论指导。
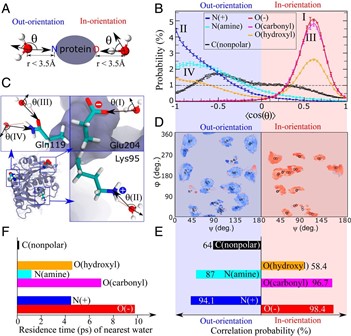
图2. 蛋白质表面基团与最近水分子之间的关系
(图片来源:Proc. Natl. Acad. Sci., 2019, 116 (39) : 19274-19281)
原文链接:
https://doi.org/10.1073/pnas.1910225116
原文作者:
Baofu Qiao, Felipe Jiménez-Ángeles, Trung Dac Nguyen and Monica Olvera de la Cruz*
附件下载: